●冠病19疫情
美国食品与药物管理局预计将在周五批准莫德纳疫苗的紧急使用授权,成为继辉瑞-BioNTech疫苗后,第二款在美国使用的疫苗。接近600万剂莫德纳疫苗最快可在本周末开始发放。
(华盛顿综合电)美国专家团支持给予莫德纳(Moderna)冠病疫苗紧急使用授权,接近600万剂莫德纳疫苗最快可在本周末开始发放。
美国食品与药物管理局(FDA)顾问团美国时间星期四以20票赞成、零票反对、一人缺席,认可疫苗的益处大于风险,通过了这项决定。这个顾问团刚在一周前支持使用辉瑞-BioNTech冠病疫苗。
FDA局长哈恩说,将会“尽快”让莫德纳疫苗有紧急使用授权。当局预计将在周五批准莫德纳疫苗的紧急使用授权,成为继辉瑞-BioNTech疫苗后,第二款在美国使用的疫苗。
顾问团成员、梅哈里医学院院长希尔德雷斯投赞成票。他说:“从今年1月获取冠病病毒的基因序列,到12月就有两种疫苗可以使用,这是个了不起的成就。”缺席的是美国国立卫生研究院专家库里拉,他认为直接给18岁以上人群授权太过宽泛了。库里拉说:“我不能确定疫苗对所有年龄的人都是好处大于风险,我希望它能更针对那些高危人群。”
美国卫生部长阿扎尔周四接受美国消费者新闻与商业频道(CNBC)采访时透露,590万剂莫德纳疫苗已经准备好分配给各州与大城市,将从本周末起开始向全国发放。
疫苗可在2至8摄氏度保存能轻易运抵乡镇偏远地区
由于莫德纳疫苗可在2至8摄氏度的一般冷藏温度中保存30天,可以轻易的把疫苗运送到乡镇与偏远地区。相比之下,辉瑞的疫苗必须在零下70摄氏度的超低温才可保存。
莫德纳疫苗的临床试验数据显示,在3万名测试者中,疫苗对预防病毒的有效率超过94%,试验中没有出现过敏反应病例。
不过,有三名接种疫苗的受试者出现了面瘫。而且,临床试验并没有包括18岁以下人群以及怀孕和哺乳期妇女,FDA的专家表示,没有足够证据证明它对这些人群有效。
美国政府今年8月已经以15亿美元(约19.9亿新元),向莫德纳订购1亿剂疫苗。这款疫苗须注射两剂,两次注射间隔28天。
美国官员早前已经表示,今年底将有4000万剂辉瑞和莫德纳的疫苗,足以为2000万人接种疫苗。然而,当局也提醒疫苗并非万灵丹,仍再三呼吁民众保持警惕,维持社交距离和戴口罩。
美国初期重点接种对象是医护人员及长期护理机构的老年人,公众将需要等待好几个月才可获得疫苗。不过,民调显示,许多美国人对于接种疫苗仍是犹豫不决。
美国是全球累计冠病确诊病例和死亡病例最多的国家,疫情没有任何缓解的迹象。根据Worldometer世界实时统计数据,美国至今累计确诊病例已超过1762万6000起,累计死亡病例已破31万7000起。

 国际特稿:白罗斯反击欧盟移民沦为棋子
国际特稿:白罗斯反击欧盟移民沦为棋子 美医学专家:“清零”策无法根除冠病
美医学专家:“清零”策无法根除冠病 韩国前总统“光州屠夫”全斗焕病逝
韩国前总统“光州屠夫”全斗焕病逝 专家:多国悄悄展开军备竞赛
专家:多国悄悄展开军备竞赛 七国集团吁采紧急行动对抗新病毒
七国集团吁采紧急行动对抗新病毒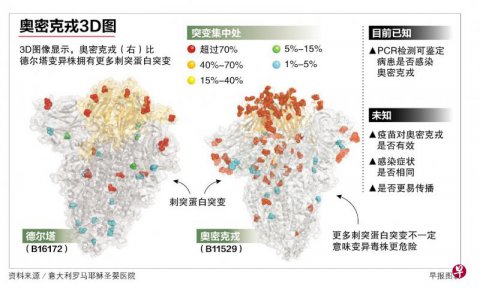 全球加紧研究奥密克戎 暂不能确定症状
全球加紧研究奥密克戎 暂不能确定症状 面临新毒株威胁 欧洲各国不敢掉以轻心
面临新毒株威胁 欧洲各国不敢掉以轻心 多国对南非实施入境限制 旅客涌向机场
多国对南非实施入境限制 旅客涌向机场